Введение в ЖХ-МС
Масс-спектрометрия обеспечивает очень эффективное средство для разделения и классификации веществ, но ее применимость ограничена газами или летучими соединениями с относительно низкой молекулярной массой, а также образцами с высокой термической стабильностью. Преимуществом жидкостной хроматографии является возможность анализа растворенных в жидком элюэнте низколетучих и термически нестабильных соединений, которые трудно анализировать с помощью ГХ-МС. В настоящее время жидкостные хроматографические масс-спектрометры (ЖХ-МС) все чаще используются в самых разных областях, таких как фармацевтика, экология, пищевые продукты и промышленные материалы.
Часть 1
Каковы преимущества ЖХ-МС?
Как правило, жидкостная хроматография (ЖХ) разделяет компоненты образца на основе различий в их сродстве (или силе удерживания) к неподвижной или подвижной фазе, а затем обнаруживает разделенные компоненты с помощью УФ-излучения, флуоресценции или электропроводности на основе их свойств. Такие детекторы в первую очередь квалифицируют вещества на основе времени удерживания и количественно определяют вещества на основе пиковой интенсивности и площади пика. Хроматография обеспечивает высокое разрешение, но точная оценка и количественный анализ веществ могут быть затруднены, если несколько компонентов элюируются приблизительно в одно и то же время, например, при одновременном анализе нескольких аналитов.
Напротив, масс-спектрометрия (МС) предлагает высокочувствительный метод обнаружения, который ионизирует компоненты пробы различными способами, затем разделяет полученные ионы в вакууме на основе их отношения массы к заряду и измеряет интенсивность каждого иона. Поскольку масс-спектры, полученные с помощью МС, могут указывать уровень концентрации ионов с заданной массой, они чрезвычайно полезны для качественного анализа. Это связано с тем, что масса - это информация, относящаяся к конкретным молекулам, и МС позволяет получить эту информацию напрямую. Однако это применимо только при измерении одного компонента. Если несколько компонентов вводятся одновременно, становится чрезвычайно сложно анализировать спектры.
Таким образом, системы ЖХ-МС сочетают в себе выдающееся разрешение разделения жидкостной хроматографии с выдающимися качественными возможностями масс-спектрометрии. Масс-спектры, полученные в результате этих измерений сканирования, предоставляют информацию о молекулярной массе и структуре элюированных компонентов, которая дополняет качественную информацию, основанную на времени удерживания, полученном с помощью других детекторов LC (рис. 1).
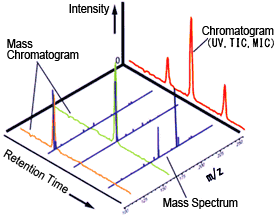
Рис. 1 Хроматограмма и масс-спектр
Кроме того, измерения SIM (мониторинг выбранных ионов) обнаруживают вещества на основе массы, которая является высокоселективным параметром. Это позволяет проводить количественный анализ, исключающий влияние примесей, даже если разделение с помощью ЖХ неадекватно. С точки зрения обеспечения как широкой применимости для широкого круга веществ, так и высокой селективности, масс-спектрометры предлагают отличные характеристики в качестве детектора LC.
Компоненты системы ЖХ-МС
Масс-спектрометрические системы включают в себя устройство для ввода образцов (например, блок ВЭЖХ или ГХ), интерфейс для подключения такого устройства, источник ионов, который ионизирует образцы, электростатическую линзу, которая эффективно вводит генерируемые ионы, блок масс-анализатора, который разделяет ионы на основе их отношения массы к заряду (m/z) и блок детектора, который обнаруживает отделенные ионы.
Доступны многие типы систем МС в зависимости от метода, используемого для разделения ионов. В этом примере показаны компоненты типичной квадрупольной МС-системы с атмосферной ионизацией, обычно используемой в качестве детектора ЖХ-МС (рис. 2).
Блок атмосферной ионизации основан на ионизации электрораспылением (ESI), атмосферно-химической ионизации (APCI) или других методах ионизации и служит источником ионов и интерфейсом с системой ВЭЖХ.
Ионы, генерируемые в этом устройстве, очищаются от растворителя, затем фокусируются в пучок с помощью октуполя или других средств, а затем доставляются к квадруполю. На квадруполь подается как постоянный ток, так и переменный ток высокой частоты, так что только ионы с целевым отношением m/z успешно проходят через квадруполь. Количество ионов, достигших детектора, преобразуется в сигнал и выводится на компьютер.
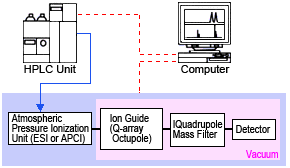
Рис. 2 Компоненты системы ЖХ-МС
Часть 2
Методы ионизации, используемые для ЖХ-МС.
Широкое использование систем ЖХ-МС началось относительно недавно.
Масс-спектрометры удаляют целевые компоненты в виде ионов в газовой фазе, а затем обнаруживают ионы в высоком вакууме. В случае систем ГХ-МС целевые компоненты уже газифицированы в блоке ГХ, поэтому их можно вводить непосредственно в блок МС без дальнейшей обработки. Однако в системе ЖХ-МС, если блок ЖХ просто подключить непосредственно к блоку МС, жидкая подвижная фаза будет испаряться, что приведет к попаданию большого количества газа в блок МС. Это снизит уровень вакуума и предотвратит попадание ионов-мишеней в детектор.
Даже при небольшом расходе 1 мл/мин элюат из установки ЖХ может увеличиваться в 1000 раз по сравнению с его объемом при испарении, в зависимости от типа растворителя, что приводит к образованию огромного количества газа. Поэтому ключевой вопрос для ЖХ-МС заключается в том, как избавиться от подвижной фазы. Следовательно, были разработаны различные интерфейсы, но все они по-прежнему имели проблемы с чувствительностью, стабильностью, удобством для пользователя или другими аспектами.
Метод ионизации при атмосферном давлении
Когда появилась ионизация при атмосферном давлении (API), улучшенный интерфейс позволил надежно получать ионы. Как следует из названия, он ионизирует образцы в условиях атмосферного давления, что делает его особенно полезным для удаления растворителей вне вакуума. В настоящее время существует в основном два типа интерфейсов API. Одним из них является ионизация электрораспылением (ESI)., который лучше всего подходит для ионных соединений с высокой полярностью (рис. 3).
ESI набирает образцы растворов на кончик капиллярной трубки, где подается высокое напряжение примерно от 3 до 5 кВ. Распыляющий газ поступает снаружи капилляра для распыления образца. Это создает тонкий туман заряженных капель с той же полярностью, что и приложенное напряжение. По мере движения этих заряженных частиц растворитель продолжает испаряться, тем самым увеличивая электрическое поле на поверхности капли. Когда сила взаимного отталкивания зарядов превышает поверхностное натяжение жидкости, происходит деление. Считается, что по мере повторения этого цикла испарения и деления капли в конечном итоге становятся достаточно маленькими, чтобы ионы образца высвобождались в газовую фазу (модель испарения ионов). ESI обеспечивает самый мягкий доступный метод ионизации, это означает, что его можно использовать для высокополярных, наименее летучих или термически нестабильных соединений. Поскольку большинство образующихся ионов представляют собой протонированные молекулы (или депротонированные молекулы), ионы сложных фрагментов не образуются. Это позволяет легко определить молекулярную массу соединений. Кроме того, поскольку он генерирует многовалентные ионы, в зависимости от соединения, даже если соединение имеет молекулярную массу 10 000, например, ионы с валентностью 20 будут иметь только отношение m/z 501, а ионы с валентностью 10 будет иметь только отношение m/z, равное 1001, что можно определить с помощью небольшого масс-спектрометра. Также можно использовать компьютерную обработку для прогнозирования молекулярной массы этих многовалентных ионов. ESI используется для анализа широкого спектра образцов, таких как природные вещества, биологические макромолекулы и фармацевтические препараты.
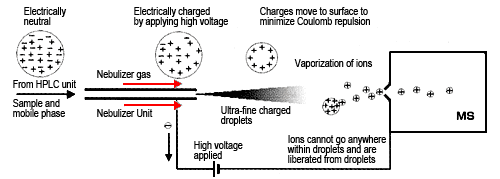
Рис. 3 Испарение ионов при ионизации электрораспылением (ESI)
Химическая ионизация при атмосферном давлении (APCI)
Представляет собой тип химической ионизации, точно так же, как CI для GC-MS (рис. 4). Хотя дизайн интерфейса похож на ESI, принцип ионизации отличается, что делает его более подходящим в основном для соединений с низкой и средней полярностью. APCI испаряет растворитель и молекулы образца путем распыления раствора образца в нагреватель (нагретый примерно до 400 °C) с использованием газа, такого как азот . Молекулы растворителя ионизируются коронным разрядом с образованием стабильных реакционных ионов.
Протоны переносятся между этими реакционными ионами и молекулами образца (ионно-молекулярная реакция) для ионизации молекул образца путем добавления или удаления протона. Известно, что эти ионно-молекулярные реакции включают несколько моделей, таких как реакции переноса протона и реакции электрофильного присоединения. Как и в случае ESI, обнаруживаются в основном протонированные молекулы (или депротонированные молекулы). Следовательно, он используется для анализа хорошо растворимых в жирах соединений или соединений, которые не ионизируются в растворе.
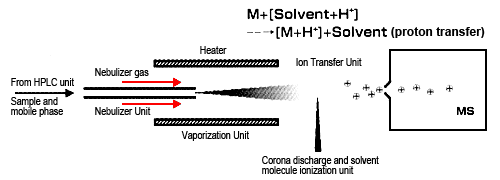
Рис. 4 Ионно-молекулярные реакции при химической ионизации при атмосферном давлении (APCI)
На рис. 5 показана взаимосвязь между методом ионизации и применимыми аналитами. Поскольку только с помощью ВЭЖХ можно измерять очень большое количество соединений, избирательное использование ESI или APCI в качестве метода ионизации теперь позволяет измерять более широкий спектр органических соединений.
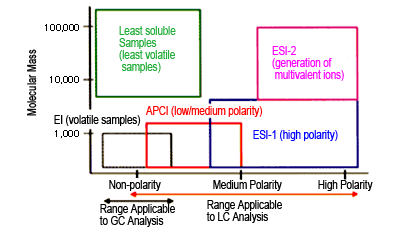
Рис. 5 Методы ионизации и применимые соединения
Часть 3
Развитие метода ионизации при атмосферном давлении (API) позволило ионизировать широкий спектр органических соединений, что расширило область применения ЖХ-МС анализа. Кстати, а какие масс-спектры получаются с помощью API? Это тема этого раздела.
Масс-спектры из API
Как описано выше, как ESI, так и APCI приводят к обнаружению в основном протонированных молекул, а также аддуктов металлов или растворителей. В этом разделе приводится сравнение этих методов с электронной ионизацией (EI), которая обычно используется в ГХ-МС. На рис. 6 представлены спектры витамина В2 (рибофлавина), полученные с помощью EI и ESI. Они нанесены на график с интенсивностью ионов по вертикальной оси и отношением массы к заряду (m/z) по горизонтальной оси.
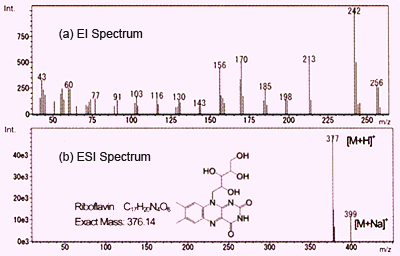
Рис. 6 Масс-спектры витамина B2
EI использует электронный пучок для высвобождения одного электрона из молекул в газовой фазе для создания молекулярных ионов (катион-радикалов). Они мгновенно взрываются, образуя группу осколочных ионов. Структурную информацию можно получить, рассмотрев структуру этих осколочных ионов. Однако во многих случаях пики молекулярных ионов не обнаруживаются. В случае рисунка 1а молекулярные ионы не обнаружены, а обнаружены только ионы-фрагменты. Получение информации о молекулярной массе с помощью EI затруднено, что требует использования дополнительного аналитического метода, такого как химическая ионизация (CI).
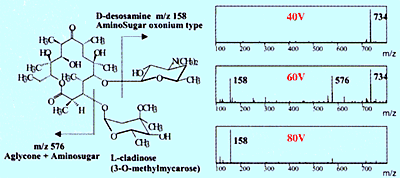
Рис. 7. Спектры диссоциации эритромицина, индуцированные столкновением.
Напротив, использование ESI, который представляет собой метод мягкой ионизации, дает простой спектр с протонированной молекулой, обнаруженной при m/z 377, и ионом аддукции натрия, обнаруженным при m/z 399, и почти без фрагментных ионов. Таким образом, с помощью API можно легко получить информацию о молекулярной массе, которая важна для предсказания структуры неизвестных соединений. (В этом примере, поскольку витамин B2 имеет основную функциональную группу, используется режим положительных ионов). фрагментарные ионы.
Тем не менее, структурную информацию можно получить с помощью API, если использовать метод, называемый диссоциацией, индуцированной столкновениями (CID), для создания ионов-фрагментов, а затем измеряя эти ионы-фрагменты. CID может происходить в области электростатической линзы (рис. 7) или с использованием масс-спектрометра тандемного типа, оснащенного камерой столкновений, которая описана ниже. На рис. 7 показан пример образования осколочных ионов из эритромицинового антибиотика путем увеличения напряжения, подаваемого на электростатическую линзу.
Эти ионы можно использовать для идентификации второстепенных компонентов, появляющихся на хроматограмме (см. Shimadzu Application News, LCMS No. C21).
Измерение многовалентных ионов
Известно, что из методов API, в частности, использование ESI иногда генерирует молекулярные ионы с несколькими зарядами для соединений, которые имеют несколько потенциальных точек ионизации. (В случае катионов это означает добавление нескольких протонов [M+nH] n+.) На уровень протонирования сильно влияет уровень pKa соединения или уровень pH раствора. При наблюдении этого типа многовалентного иона информация о молекулярной массе может быть получена даже для соединений с молекулярной массой, превышающей диапазон измерения масс-спектрометра. Поэтому он используется для измерения очень больших и высокополярных биологических макромолекул, таких как белки и нуклеиновые кислоты.
На рис. 8 показан спектр ESI лошадиного миоглобина в качестве примера белка. При этом были обнаружены ионы с валентностью от 9 до 20, а молекулярная масса, рассчитанная методом деконволюции, составила 16951,3. По сравнению с теоретической молекулярной массой 16951,5, рассчитанной по составу аминокислот, ошибка составила менее 0,002 %, что указывает на то, что получено чрезвычайно точное значение.
Это большое отличие от ГХ-МС, который обычно дает пики только для z=1.
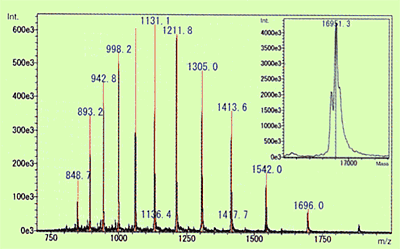
Рис. 8. Молекулярная масса миоглобина в сердечной мышце лошади, рассчитанная с использованием спектра ESI и деконволюции.
Часть 4
Аналитические условия для ЖХ-МС
Для ЖХ-анализа доступны различные режимы разделения, такие как разделение (нормальная или обращенная фаза), эксклюзия по размеру и ионный обмен, в зависимости от свойств целевых компонентов. Тип стационарной и подвижной фаз (вода, органический растворитель, реагент, регулирующий рН, или буферный раствор) выбирают на основе характеристик образца, желаемого уровня разделения и других целей анализа.
В отличие от этого, жидкостная хроматомасс-спектрометрия с ионизацией при атмосферном давлении (LC-MS API) используется для анализа органических соединений либо с полярностью от низкой до средней (ионизация при атмосферном давлении - APCI ), либо от средней до высокой (ионизация электрораспылением - ESI). Поэтому часто используется обращенно-фазовый режим, который подходит для разделения и ионизации таких соединений.
Поскольку API включает распыление образца, для обеспечения надежного анализа необходимо использовать летучую подвижную фазу. Мобильные фазы, используемые для API, кратко описаны ниже. В дополнение к основным подвижным фазам воды, метанола и ацетонитрила уксусная кислота также обычно используется для регулирования уровня pH.
Для буферных растворов используют летучие соли ацетат аммония и формиат аммония. Кроме того, для образования реакционных ионов для APCI необходимы протонные растворители, а полярные растворители также считаются важными для API, поскольку полярные растворители необходимы для растворения полярных или ионных соединений для ESI.
Подвижные фазы, подходящие для
основных растворителей подвижной фазы API
- Спирты, такие как метанол и этанол
- Ацетонитрил
- Вода (при необходимости
Реагенты, регулирующие рН (летучие, примерно до 10 мМ) - Уксусная кислота, муравьиная кислота и ТФУ ( трифторацетат) (кислая)
- Водный аммиак (основной)
- Ацетат аммония и формиат аммония (буферный раствор)
Реагенты с относительно летучими ионными парами *
- Перфторкарбонат (от C2 до C8) (для удержания основных соединений)
- Дибутиламин, триэтиламин и т. д. (для удержания кислотные соединения)
* Требуется особая осторожность, так как они могут оставаться в системе даже после замены подвижных фаз.
Используемые органические растворители *
- ДМСО, ДМФ, ТГФ, ацетон, сложные эфиры, хлороформ, бензол и гексан.
* Если присутствует «основной растворитель подвижной фазы», обычно не возникает проблем, если подвижная фаза содержит некоторые из этих органических растворителей. (Однако эффект ионизации уменьшается по мере увеличения концентрации.)
Напротив, фосфатный буферный раствор, который обычно используется для ЖХ-анализа, может осаждать свои нелетучие соли на границе раздела, что может вызвать механическое повреждение. Это может привести к физическому повреждению, такому как загрязнение игольчатого электрода для APCI или создание помех для создания мелких заряженных капель и снижение чувствительности для ESI.
Кроме того, неполярные растворители, такие как гексан, очень мало способствуют ионизации молекул образца при использовании APCI. Следовательно, аналитические условия, в которых используются такие подвижные фазы, нельзя использовать без модификации.
Переход с анализа ЖХ на анализ ЖХ-МС
Обычно, чтобы перейти от анализа ЖХ к анализу ЖХ-МС, используйте текущие условия подвижной фазы ЖХ в качестве эталона, а затем исследуйте внесение изменений, таких как переход на летучую соль без изменения уровня pH или смешивание полярных растворителей с неполярными растворителями.
Поскольку существует ограниченное количество подвижных фаз, подходящих для ЖХ-МС, следует также пересмотреть тип используемой колонки.
Например, приняв за стандарт колонку C18 (октадецил) для обращенно-фазового режима, попробуйте использовать C30 для увеличения удерживания, C8 или C4 для уменьшения удерживания или фенил или CN для повышения селективности разделения. Если разница во времени элюирования слишком велика или пики слишком широкие, используйте градиентное элюирование.
Если подвижная фаза и концентрация соли подходят для АФИ, то также можно использовать режимы исключения размера или ионного обмена.
Обнаружение с хорошей чувствительностью
ESI - это метод ионизации, при котором соединения, существующие в виде ионов в растворе, извлекаются через газовую фазу путем распыления раствора в электрическом поле высокого напряжения. Для достижения высокой чувствительности важно эффективно высвобождать ионы из капель, например, путем получения как можно более мелких капель, снижения поверхностного натяжения капель и оптимизации рН капель. В частности, на чувствительность влияет рН подвижной фазы.
Например, если основное соединение обнаруживается как положительные ионы, добавление кислотного реагента (AH) смещает равновесие в следующем уравнении вправо, что должно повысить чувствительность.
Как правило, желаемая подвижная фаза имеет значение pH на 1 или 2 ниже, чем значение pKa образца. M-NH 2 + АН →[M-NH 3 ] + + A - И наоборот, для кислых соединений добавьте щелочной реагент ( B ) или используйте подвижную фазу с pH на 1 или 2 выше, чем значение pKa образца. M-COOH + B → [M-COO] - + BH +
В случае нейтральных соединений без ионной функциональной группы добавление летучей соли, такой как ацетат аммония, иногда может повысить эффективность ионизации в виде ионов аддукта. М + ВН + → [М+ВН] + М + А - → [М+А] –
Кроме того, также может быть эффективным увеличение доли органического растворителя для ускорения испарения растворителя. Если добавление этих элементов влияет на разделение ЖХ, раствор также можно добавить в постколонку.
APCI - это метод, который ионизирует молекулы образца (M) путем переноса протонов между M и реакционными ионами (BH+), генерируемыми из растворителя подвижной фазы коронным разрядом. Если сродство к протону M больше, чем сродство к протону B, то протон переносится от B к M. Эта разница в сродстве к протону между подвижной фазой и образцом влияет на чувствительность. M + BH + → MH + + B
Режим положительных ионов подходит для соединений с аминогруппами, амидами или карбонилами, которые имеют сильное сродство к протону, тогда как режим отрицательных ионов подходит для соединений с карбоксильными группами или фенольными гидроксильными группами.
Как упоминалось выше, для APCI требуется протонный растворитель, где растворы метанол/вода, как правило, обеспечивают более высокую эффективность ионизации, чем растворы ацетонитрил/вода.
APCI можно использовать в режимах исключения нормальной фазы и размера, и он обеспечивает ионизацию в диапазоне скоростей потока от 0,2 до 2 мл/мин. Кроме того, одним из его преимуществ является то, что на него меньше влияют соли, чем на метод ESI.
Как описано выше, для ЖХ-МС важно выбрать соответствующие аналитические условия, тщательно учитывая ионизацию и разделение целевых компонентов методом ЖХ.
Часть5
Роль блока масс-спектрометрии
Английский физик Дж. Дж. Томсон использовал тот факт, что поток заряженных частиц изгибается в электрическом или магнитном поле, для разработки прибора, который мог бы разделять заряженные частицы по массовому числу.
В его приборе, в котором использовалась электронно-лучевая трубка, катионы с одинаковым соотношением заряда е и массы m сходились по одной и той же параболе. Когда он измеряет молекулу газа неона, параболы для 20 Ne и 22Ne (оба являются одновалентными катионами) немного различались, что доказывало существование изотопов (1912 г.). Если использовать это электромагнитное взаимодействие, ионизированные соединения можно разделить и измерить в соответствии с отношением массы к заряду (m/z).
Типы масс-спектрометров
Основные компоненты масс-спектрометра состоят из блока ввода пробы, блока ионизации, блока масс-анализатора и блока детектирования ионов. В последние годы в большинстве систем ЖХ-МС используются методы ионизации при атмосферном давлении, такие как ESI или APCI.
Однако для блока масс-спектрометра, который разделяет ионы, использовалось более широкое разнообразие моделей. В прошлом для измерения органических соединений часто использовались модели магнитного сектора, квадрупольные и время пролетные модели, но постепенно увеличивается их доля относительно более дешевыми квадрупольными моделями.
Кроме того, были разработаны система МС с ионной ловушкой, которая временно накапливает ионы выбранного диапазона перед их разделением по массе, а также тандемная или гибридная система МС, объединяющая несколько блоков МС (таблица 1).
Каждый из этих различных типов систем МС использует свои особенности и используется в соответствии с аналитическими задачами.
Таблица 1
Различные масс-спектрометры, основанные на различных методах разделения масс
|
Модели передачи ионов |
Сканирующие модели |
Магнитный сектор: B |
|
Модели без сканирования |
Время полета: TOF |
|
|
Модели ловушек |
Ионная ловушка: |
|
|
Комбинированный МС |
Тандем |
EBEB (электрическое поле - магнитное поле - электрическое поле - магнитное поле), BEBE (магнитное поле - электрическое поле - магнитное поле - электрическое поле) и QqQ |
|
Гибридный |
Q-TOF, Q-IT, IT-TOF, TOF-TOF и Q-FTICR |
|
Магнитный сектор МС
Магнитный сектор МС исторически использовался дольше всех (рис. 9).
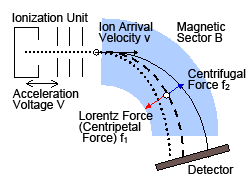
Рис. 9 Схема МС магнитного сектора
К ионам, генерируемым в блоке ионизации, прикладывается высокое напряжение от 2 до 8 кВ, чтобы ускорить их попадание в магнитный сектор. Согласно правилу левой руки Флеминга, ионы ускоряются в направлении, перпендикулярном скорости v и магнитному полю, что приводит к искривлению траектории.
(Правило левой руки Флеминга: на входе в магнитное поле на рисунке 1 положительно заряженные ионы движутся вправо (в направлении протекания тока), поэтому средний палец левой руки указывает вправо. Магнитное поле течет к наблюдателю, поэтому указательный палец также указывает на наблюдателя. Это означает, что результирующая сила (направление большого пальца) направлена вниз, то есть вправо по отношению к поступательному движению положительно заряженных ионов.)
Ионы испытывают лоренцеву реакцию . сила f 1от магнитного поля, которое можно рассчитать по уравнению
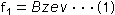
(где B: плотность магнитного потока, z: номер заряда, e: элементарный заряд и v: скорость)
При изменении направления движения объекта на объект действует центробежная сила f 2 , выражаемая уравнением
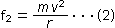 (где m: масса и r: радиус пути)
(где m: масса и r: радиус пути)
Чтобы ион прошел через область магнитного поля и достиг детектора, он должен двигаться по криволинейной траектории заданного радиуса. Другими словами, он должен двигаться с силами f 1 и f 2 в равновесии, как описано уравнением (3).
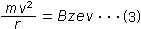
При этом кинетическая энергия ионов, ускоренных напряжением V, описывается уравнениями (4)
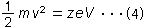
и уравнение (5) получается из уравнений (3) и (4).
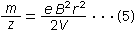
В этом случае движение ионов удовлетворяет уравнению (5).
Поддерживая постоянное напряжение ускорения ионов V и изменяя магнитный поток B (или сохраняя постоянным B и изменяя V) в уравнении (5), детектор, размещенный на соответствующем радиусе пути r, может обнаружить любую конкретную массу m.
В реальных масс-спектрометрах с магнитным сектором используется только один детектор ионов, а ускоряющее напряжение и радиус кривой поддерживаются постоянными при сканировании магнитного потока. Это означает, что ионы с разной массой все проходят по пути через магнитное поле один за другим и достигают детектора. При каждом сканировании магнитного поля получают один масс-спектр.
Характеристики МС магнитного сектора
Диапазон измерения систем МС с магнитным сектором обычно составляет от 10 до 10 000, хотя он зависит от ускоряющего напряжения V и конструкции прибора. Разрешение около 2000 может быть получено при использовании модели магнитного сектора с одной фокусировкой или несколько десятков тысяч при использовании модели магнитного сектора с двойной фокусировкой.
До появления в последние годы высокопроизводительных времяпролетных МС и МС с ионным циклоном магнитный секторный спектрометр с двойной фокусировкой был единственным типом, способным проводить измерения с таким высоким разрешением.
В системах MS магнитного сектора сила магнитного поля оказывает большое влияние на производительность, а это означает, что для повышения производительности требовались все более и более крупные системы.
Поскольку системам МС с магнитным сектором требуется чрезвычайно высокий уровень вакуума 10-7 Па, их трудно сопрягать с блоком ЖХ, а их недостатком является более низкая скорость сканирования, чем у других систем МС. Поэтому в настоящее время они редко используются в качестве систем ЖХ-МС. С другой стороны, они относительно легко подключаются к ГХ. Следовательно, такие системы ГХ-МС используются для анализа диоксинов из-за выдающихся возможностей мониторинга выбранных ионов с высоким разрешением (HR-SIM) МС с магнитным сектором.
